Атом - наименьшая
составная часть вещества, сохраняющая его химические свойства. Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13
см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10–8 см. В обычных
условиях атомы электронейтральны — число электронов в атоме равно числу
протонов в атомном ядре. Заряд ядра определяет порядковый номер атома в
Периодической системе элементов Д.И. Менделеева. Так как масса электрона
в ~2000 раз меньше массы протона или нейтрона, масса атома примерно равна
сумме масс нейтронов и протонов, образующих атомное ядро. Простейшим атомом
является атом водорода, состоящий из одного протона и одного электрона.
При одном и том же числе протонов в ядре, оно может содержать различное
число нейтронов. Такие ядра называются изотопами. Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой. Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
Состояние электрона в атоме характеризуется значением его орбитального
момента L, определяемого квантовым числом l, L = ћ[l(l+1)]1/2.
При данном значении l состояния нумеруются в порядке возрастания квантового
числа n, пробегающего значения l+1, l+2,... по мере возрастания энергии.
В нерелятивистском приближении уровни с заданными значениями n и l вырождены
по проекции орбитального момента, характеризуемой квантовым числом ml,
принимающей 2l+1 значение ±l, ±(l-1),..., ±1, ±0 и проекции спинового
момента ms электрона, принимающей 2s+1 = 2 (s = 1/2) значения
ms = ±1/2. Таким образом, кратность вырождения N уровня с определенными
значениями квантовых чисел n и l равна N = (2s+1)(2l+1) = 2(2l+1). Совокупность
2(2l+1) состояний с данными n и l образует электронную оболочку.
Согласно принципу Паули в каждом из этих состояний может находиться один
электрон. Если все состояния электронной оболочки заняты электронами, оболочка
называется замкнутой.
Замкнутая s оболочка (l=0) содержит 2 электрона
N = (2s+1)(2l+1) = (2·(1/2)+1)(2·0+1) = 2.
Замкнутая р оболочка (l=1) содержит 6 электронов
N = (2s+1)(2l+1) = (2·(1/2+1)(2·1+1) = 6.
Замкнутая d оболочка содержит 10 электронов.
Все электроны с заданным квантовым числом n образуют электронный
слой, содержащий 2n2 электронов. Слои с n = 1, 2, 3,... называют
в соответствии с принятой для рентгеновских спектров терминологией K, L,
M, N-слоями. Максимальное число электронов в K, L, M, N-слоях приведено
в таблице.
Максимальное число электронов K, L, M, N-слоях
| K-слой | L-слой | M-слой | N-слой |
| n = 1 | n = 2 | n = 3 | n = 4 |
| l = 0 | l = 0, 1 | l = 0, 1, 2 | l = 0, 1, 2, 3 |
| 2 электрона | 2 + 6 = 8 электронов |
2 + 6 + 10 = 18 электронов | 2 + 6 + 10 + 14 = 32 электрона |
Наиболее близко к ядру расположен К-слой, затем L-слой и т.д. При заданном
значении n сначала заполняются состояния с l = 0, затем l = 1, l = 2 и т.д.
Последовательное заполнение электронных слоев объясняет Периодический
закон элементов, открытый Д.И. Менделеевым. Периоды в Периодической системе
Д.И. Менделеева соответствуют последовательному заполнению оболочек. Для
элементов 1 периода происходит заполнение оболочки 1s. Для элементов 2 и
3 периодов — заполнение оболочек 2s, 2p, 3s, 3p, 3d. Однако по мере увеличения
числа электронов (заряда ядра Z) такой порядок заполнения нарушается из-за
конкуренции близких по энергии связи электронов. Справедливо следующее правило:
чем меньше l, тем сильнее волновая функция проникает в область, экранируемую
облаком внутренних электронов. В результате этого при заданном значении
n энергия электронов возрастает с увеличением l (рис.).
Например, электроны 4s оказываются сильнее связаны, чем электроны
3d. В основе последовательности заполнения электронных оболочек многоэлектронных
атомов лежит правило Маделунга.
|
Правило Маделунга. Из двух оболочек ниже по энергии располагается та, для которой величина n = l оказывается наименьшей. Если для двух оболочек значения сумм n = l совпадают, то ниже по энергии лежит оболочка с меньшим значением n. |
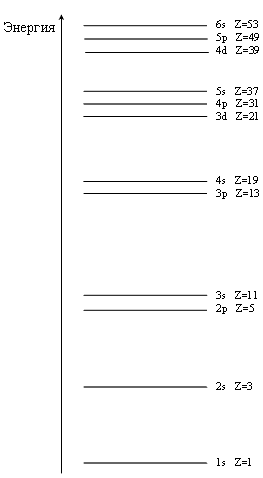 Рис. Относительное расположение электронных оболочек атомов (не в масштабе). Справа указан заряд Z ядра атома, с которого начинается заполнение указанной подоболочки. |
Распределение электронов в атоме по оболочкам определяет
его электронную конфигурацию. Так, например, электронная конфигурация атома
27Al, имеющего 13 электронов, записывается в виде 1s2
2s2 2p6 3s2 3p1. Последовательно
выписываются электронные оболочки, начиная от ближайшей к ядру. Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Для каждой электронной конфигурации можно построить определённое
количество термов (состояний), характеризующихся определёнными значениями
полного орбитального момента
![]()
полного спинового момента
![]()
и полного момента количества движения
![]()
всех электронов данного атома.
Электростатическое и спин-орбитальное взаимодействия электронов атома
приводят к тому, что терм расщепляется на несколько состояний - мультиплет,
число компонентов которого определяется числом возможных ориентаций векторов
![]() и
и
![]() в пространстве,
т.е. числом возможных значений квантового числа j.
в пространстве,
т.е. числом возможных значений квантового числа j.
Состояния атома с различными значениями L обозначаются заглавными
буквами латинского алфавита:
|
L = |
0 |
1 |
2 |
3 |
4 |
5 |
|
S |
P |
D |
F |
G |
H |
Сверху слева от этого символа указывается величина 2s+1, а справа внизу
значение полного момента J. Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Конкуренция спин-орбитального и электростатического взаимодействий
определяет порядок сложения орбитальных и спиновых моментов. В том случае,
когда электростатическое взаимодействие много больше спин-орбитального,
орбитальные моменты отдельных электронов складываются в полный орбитальный
момент L. Спиновые моменты отдельных электронов складываются в полный спиновый
момент S.
![]() =
=
![]() +
+
![]() .
.
Такая схема связи называется L–S связью. В основном она реализуется для
основных состояний лёгких ядер.
В случае, когда спин-орбитальное взаимодействие много больше
электростатического, полные моменты отдельных электронов объединяются в
полный момент атома
![]() .
Такая схема связи называется j–j связью и реализуется в основном в тяжелых
ядрах.
.
Такая схема связи называется j–j связью и реализуется в основном в тяжелых
ядрах.
Для определения основного терма данной конфигурации используют
эмпирические правила Хундта.
-
Ниже по энергии лежит терм, у которого мультиплетность является максимальной.
-
При равенстве мультиплетностей нескольких термов минимальной энергией обладает терм с максимальным значением суммарного орбитального момента конфигурации.
-
Если атомная подоболочка заполнена менее, чем наполовину, наименьшую энергию имеет состояние с минимальным значением J, если атомная оболочка заполнена более, чем наполовину, то наименьшую энергию имеет состояние с максимальным J.
Наряду с электронной конфигурацией, соответствующей наибольшей энергии связи всех электронов атома, при возбуждении одного или нескольких электронов образуются возбуждённые электронные конфигурации. Переходы между различными термами атома образуют спектр возбуждённых состояний атома.